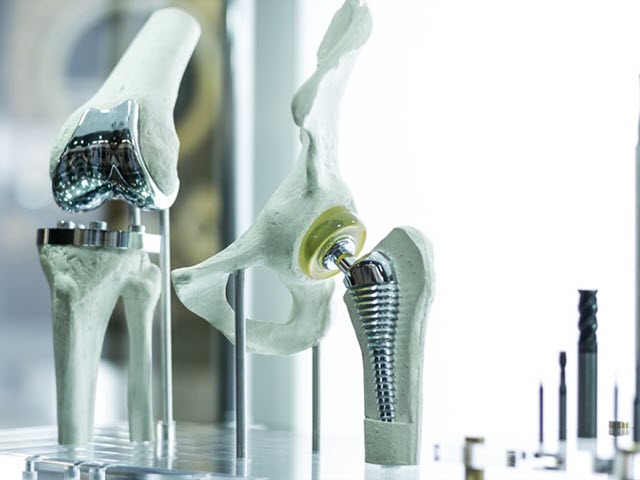
成功提交FDA 510(k)对你的市场成功至关重要。不完整或不准确的提交可能导致失败,并可能延迟您的产品发布。
《食品、药物和化妆品法》510(k)或上市前通知(PMN)部分要求制造商在新医疗器械上市前90天通知FDA他们的上市意图。具体来说,如果医疗设备制造商打算首次将一种设备投入商业销售,或者他们正在重新引入一种可能影响其安全性的有重大变化的设备,则必须提交他们的510(k)或PMN。这些变化包括对设计、材料、化学成分、能源、制造工艺或预期用途的修改。
我们在文章中为您介绍了处理510(k)项提交的最佳方法,5种方法确保您的510k提交测试顺利进行。
我们的510测试服务
选择适当的510(k)试验的谓词和提交的装置必须设计和执行的结果文件和报告,以证明等价性。
Element提供广泛的测试服务,以帮助您获得市场准入,从化学和机械测试到药物测试的组合装置。我们与您的监管团队密切合作,帮助您选择适合您510(k)提交的测试。除了常用的标准,我们聘请的专家可以制定非标准的测试协议,以评估没有标准化测试的设备的特定功能方面。
我们已通过FDA注册和ISO/IEC 17025认证,以确保我们所进行的510(k)测试的技术完整性,确保您的设备被接受为您提交的产品的组成部分。
欲了解更多关于我们医疗设备测试服务的信息或索取报价,联系我们今天。
其他药物测试服务