文章
医疗器械项目试验方案的重要性
在计划任何测试项目时,开发一个测试协议是至关重要的。了解研究目标和方法将有助于确保测试项目的成功,并降低正在进行和未来测试项目的风险。协议应该明确说明为什么和如何完成测试,必要的材料是什么,最重要的是,数据将如何呈现和分析。乐动娱乐官网
我们经常会问:“我需要一个测试协议?”或者“我该如何发展呢?”本文件概述的协议的典型部分。我们在开始学习之前,强烈建议其测试协议到位,将与您一起制定你的测试策略。
为什么有一个测试计划如此重要?
无论您是在内部进行测试,或将其外包给可信赖的合作伙伴,测试协议可作为捕捉预期,验收准则和监管要求,及适用标准的主要通信工具,并引导您完成创建计划项目。这几乎就像一张地图。的协议也相应文档此信息在未来可重复性,并保持团队在同一页上与版本控制。不可避免的是,当你从当前位置继续前进,有人在将来要么试图复制你的学习或用于未来的测试目的的信息。有一个明确的协议有助于防止未来做了什么,为什么做,以及它是如何执行的不确定性。
你该如何开始呢?
有测试协议的几个标准的部分,并根据您的监管策略,你可能要包括所有的人,或根据需要对齐与您的设计历史文件进行修改。其中一些项目可能在其他文件中概述,并可能是多余的有在这两个地方。典型协议部分被概述如下:
- 范围
- 目的
- 参考文档
- 测试样品
- 乐动娱乐官网材料和设备
- 方法
- 验收标准
- 异常条件
- 数据分析和文档需求
- 参考
修订记录
适当的测试协议需要时间来开发,并且应该在项目的开始分配足够的资源。乐动LOL由于您试图节省时间,所以在项目中追溯或中途编写协议通常会导致测试报告中的延迟和不明确的预期。如果制定了正确的步骤,那么延迟就可以很容易地避免,特别是如果您不按常规执行测试的话。根据我们的经验,最成功的客户是那些在一开始就预先考虑确定监管需求和风险,然后通过协议而不是匆忙行动来减轻监管需求和风险的客户。
美国食品药物管理局发布了指导文档2019年12月20日关于上市前提交的可能有助于审查的非临床试验台性能测试信息的推荐内容和格式。
范围、背景和目的——目标是什么?为什么?
大多数协议都从项目的范围或背景开始。它为该设备以及它被评估的原因奠定了基础。目标或目的定义输出。明确的目标为项目设定基调,并确定要回答哪些问题或提出哪些假设。为了增加影响和清晰度,下面列出了几个例子:
- 进行试验以评估膝关节部分置换术的强度。
- 描述单髁膝关节置换术系统的前后、中外侧和旋转约束行为。
- 该测试包括如何根据在体外环境中特定载荷条件下确定的固有关节设计所描绘的运动来量化单方膝关节置换术的约束。参照ASTM F1223,该测试的特点是前后拉伸、中横向剪切和旋转松弛。结果将与谓词进行实质上的等价性比较。
参考文档
我们问新客户的第一个问题是:“您有想要测试的测试标准吗?”答案通常是肯定的。如果没有,那么可能有一个类似的标准可以参考或偏离。本部分应列出任何相关标准,并对任何预期偏差进行评论。FDA的指导文件也可以作为参考,因为它们可能概述了所需的测试。
测试样品、材料和设备乐动娱乐官网
材料部分乐动娱乐官网应概述测试所需的所有组件、数量和其他相关信息。维护可追溯性,以确保对要测试的内容有一个清晰的期望,这也很重要。
下面是一个示例表:

测试样本部分中另一个有用的项是最坏情况的证明。对于医疗设备行业来说,确定用于测试的最坏情况配置至关重要。将此内容与任何内容一起包含在协议中是有帮助的有限元分析因为这通常是用户或未来的团队成员了解为什么选择这种特定尺寸的设备的唯一途径。理解这些信息有助于快速识别问题或其他风险,并在项目开始时解决它们。
材料部分乐动娱乐官网还包括将要使用的测试设备或仪器。确定测试框架的负载能力和类型有助于确保预期负载在校准范围内,并将任何设备的变异性降到最低。还可以包含通用的调优参数,以降低风险。fixture和测试环境可以概述,不过它们也可以在方法部分中列出。
方法
方法或过程部分概述了实际的测试步骤。它们通常符合适用的FDA指导文件和ASTM或ISO测试规范。如果您不确定如何开始使用这个部分,标准中的程序部分通常是最好的地方。
方法部分应概述测试项目的测试参数:
- 试样制备 - 特定客户的汇编指令
- 测试配置
- 测试频率
- 目标周期
- 用于加载选择的目标加载数据或方法
- 测试环境
- 检查率
- 控制模式(力/位移)
- R比率
- 波形
本部分还应参考以前的研究或测试报告,以确保可重复性。如果方法部分有几种不同的测试配置,那么上面列出的参数应该为每种测试类型列出。方法部分的一个关键区域是列出任何特定的汇编、拆卸或处理信息的大纲。测试块或加载方向、拧紧力矩和流体收集信息也应概述。
另一个关键部分是记录任何定制夹具或安装的指令。通常情况下,被包括在测试设置或固定装置的绘图的示意图,使其清除设备是如何进行测试。开发自定义的测试方法时,这一点尤为重要。
验收标准和异常情况
定义数据时,您要查找的数据和您要比较的数据需要文档化。根据之前的测试或谓词测试确定验收标准,可以帮助相关人员评估生成的数据,并在需要时快速做出调整。它还驱动过程部分确保与谓词之间存在“苹果到苹果”的比较。如果您的设备没有可用的谓词,那么明确的验收标准定义就非常重要。对测试协议的任何异常、变更或修改也应加以注意并加以说明。
数据分析和文档需求
测试方案计划还应包括公司内部报告程序的报告要求。类似于方法部分,ASTM或ISO测试标准概述了用于测试的通用交付物。然而,如果你还需要原始数据,特定的照片,或检查,这些应该清楚地概括在这个部分。统计分析资料也应在此概述,以便进行数据评估。
还应该考虑您计划提交的监管环境。例如,日本的PMDA与其他监管机构有不同的要求,需要额外的信息和流程图。提前了解这一点将使捕获必要的数据和采取主动措施减少任何提交风险变得更容易。
参考
参考文献部分应列出任何适当的参考文献,如试验标准、法规指南、以前的试验报告、出版的文献等。本节帮助确定协议中的信息从哪里来,以及从哪里访问这些信息以获得更多细节。
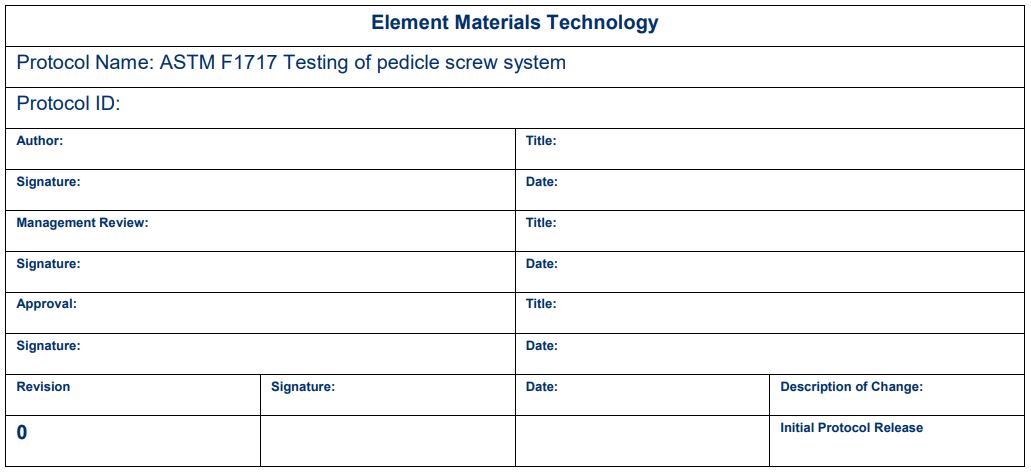
修订历史及签名
一旦协议完成,我们建议进行签名和修订控制,以确保所有各方都知道任何更改,并使每个人都能在同一页上。研究负责人、当地管理人员和检测实验室签字是常见的。可以根据需要添加其他签名。这确保了多个人都在关注这个项目。下面显示了一个示例签名块。根据内部进程的不同,一些协议在首页有签名块,而另一些协议在末尾有签名块。
结论
通常客户已经购买或开发了一定数量的部件,并且只有一次机会使测试程序正确。在实现了测试协议的测试程序和没有实现测试协议的测试程序中存在着实质性的差异。一定要在协议和测试计划上投资。一个协议和计划将减少你的风险,防止混淆,设定明确的期望,并保存必要的信息,以供将来参考和使用。
Element获得ISO 17025认证,是世界上最广泛的医疗设备测试范围之一骨科和心血管植入物测试,以EMC / EMI /产品安全测试以及生物和包装评价。联系我们讨论我们如何帮助您的测试项目。
通过查找相关的文章给你核
确定了将近190年
更多来自元

部门
医疗设备
作为一家综合性测试合作伙伴,您可以享受单一供应商源的优势为您所有的测试需求,从力学测试和环境模拟到EMC和无线设备测试。
阅读更多

服务
的510(k)测试
成功的FDA 510(k)的提交是你的市场成功的关键。不完整或不准确的意见,可导致失败,而且可能延误您的产品推出。
阅读更多

资源
医疗器械检测提示
对许多制造商来说,准备医疗设备测试程序是一项挑战,特别是当它是一种新产品或时间有限的时候。我们的医疗设备专家分享了他们的测试技巧和最佳实践。
阅读更多
订阅中心
注册获取免费资源乐动LOL
访问Element的电子邮件订阅中心,接收最新的行业新闻、技术白皮书、案例研究、网络研讨会和即将到来的活动。
阅读更多



